Миелодиспластический синдром
барельеф на стене цена Цена указана за 1 кв /м. Барельеф выполнялся в мастерской на тканной основе и монтировался уже по месту – 3 дня. Размер: 12 кв.м. Срок выполнения – 5 недель.
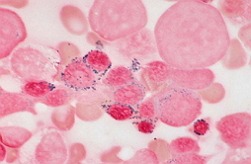 Миелодиспластический синдром – это широкий диапазон патологий, которые соединяет воединыжды единый патогенетический механизм развития, заключающийся в сочетании диспластических конфигураций костного мозга и цитопенией в циркулирующей крови. Каждое из болезней, сопровождающихся развитием миелодиспластического синдрома, делает завышенный риск развития острого миелобластного лейкоза.
Миелодиспластический синдром – это широкий диапазон патологий, которые соединяет воединыжды единый патогенетический механизм развития, заключающийся в сочетании диспластических конфигураций костного мозга и цитопенией в циркулирующей крови. Каждое из болезней, сопровождающихся развитием миелодиспластического синдрома, делает завышенный риск развития острого миелобластного лейкоза.
В ближайшее время дилемме миелодиспластического синдрома уделяется неограниченное количество научных работ, потому что частота заболеваемости данной патологией существенно возросла, а принятой действенной терапии до сего времени не создано. Не считая того, отмечается прирост заболеваемости первичным миелодиспластическим синдромом, который поражает лиц юного возраста, что разъясняется значимым ухудшением экологической обстановки.
Группу риска по развитию миелодиспластического синдрома составляют в большей степени старые пациенты.
Миелодиспластический синдром у деток является скорей исключением из правил, потому что преждевременное обнаружение данного состояния очень проблемно.
Причины миелодиспластического синдрома
Преимущественное большая часть случаев миелодиспластического синдрома относится к категории идиопатического этиопатогенетического варианта, при котором не удается найти точную причину его развития. Вторичный миелодиспластический синдром встречается только посреди пациентов онкологического профиля, и дебют его развития приходится на период после внедрения химиотерапии. Данная категория пациентов отличается очень брутальным течением миелодиспластического синдрома, также резистентностью в отношении медикаментозной терапии. Препараты, которые используются в лечении онкологических болезней (Циклофосфан, Топотекан) оказывают повреждающее действие на геном, что провоцирует развитие миелодиспластического синдрома.
Существует широкий диапазон модифицируемых причин риска, устранив которые, реально избежать развития миелодиспластического синдрома, к которым относится курение, воздействие ионизирующего облучения и паров бензола.
Большинство онкологов держится представления, что главным фоном для развития острого лейкоза является миелодиспластический синдром. Рефрактерная анемия является самой всераспространенной формой миелодиспластического синдрома и многие спецы в практической деятельности отождествляют эти понятия. Принципным различием рефрактерной анемии от традиционного варианта понижения концентрации гемоглобина в крови, будет то, что при миелодиспластическом синдроме в костном мозге пациента скапливается огромное количество бластных клеток, составляющих до 30% всего клеточного состава.
В развитии миелодиспластического синдрома огромное значение имеет эффективность клеточной продукции в костном мозге. Вследствие органических и морфологических конфигураций костного мозга в организме хворого развиваются компенсаторные механизмы экстрамедуллярного гемопоэза, сопровождающиеся гепатоспленомегалией. Патогенетическую базу миелодиспластического синдрома составляет нарушение пролиферации и созревания кровяных клеток на уровне костного мозга, в итоге чего появляется огромное количество бластных клеток, владеющих всеми признаками злокачественности.
Симптомы миелодиспластического синдрома
Клинические проявления миелодиспластического синдрома впрямую зависят от степени поражения миелопоэза, потому в исходной стадии заболевания у пациента наблюдается бессимптомный период, который может продолжаться достаточно длительно. В ситуации, когда у пациента миелодиспластический синдром появляется за счет преимущественного анемичного симптомокомплекса, у него наблюдается завышенная слабость, выраженная бледнота видимых кожных покровов, отсутствие аппетита.
Повышенная расположенность к болезням заразной природы свидетельствует о нейтропении. Не считая того, у данной категории пациентов отмечается завышенный риск развития осложнений воспалительного нрава. Но самым томным в отношении воздействия на самочувствие пациента является тромбоцитопенический компонент миелодиспластического синдрома, который проявляется в развитии геморрагического симптомокомплекса в виде завышенной кровоточивости, нередких эпизодов носового кровотечения и развития петехиальных частей сыпи на кожных покровах.
Качественная диагностика миелодиспластического синдрома должна включать оценку интенсивности клинических проявлений, также конфигураций характеристик клеточного состава не только лишь периферической крови, да и аспирата костного мозга. Так, пре обнаружении признаков рефрактерной анемии, лейкоцитопении либо тромбоцитопении, также при сочетании этих нарушений у лиц приклонного возраста следует представить наличие миелодиспластического синдрома.
Рефрактерная анемия характеризуется сочетанием с анизоцитозом и макроцитозом, что проявляется в увеличении усредненного объема клеток эритроцитарного ряда. Тромбоцитопения при миелодиспластическом синдроме в большинстве случаев не добивается критичных значений, но сопровождается конфигурацией размеров тромбоцитарных клеток, также понижением их гранулярности. Не непременно при миелодиспластическом синдроме обязано иметь место понижение показателя лейкоцитов. Более специфичным аспектом является изменение лейкоцитарной цитоплазматической гранулярности с наличием псевдопельгеровских клеток. Повышение концентрации моноцитарных кровяных клеток свидетельствует в пользу развития приобретенного лейкоза миеломоноцитарного типа.
Высокоточными способами диагностики, владеющими фактически 100% достоверностью, является иммунофенотипирование, также цитохимический анализ аспирата костного мозга, позволяющий найти специальные ферменты соответствующие только для бластных клеток.
Лечение миелодиспластического синдрома
Принятие решения в отношении выбора стратегии ведения пациента с миелодиспластическим синдромом почти во всем находится в зависимости от выраженности лабораторных проявлений. Так, отсутствие признаков геморрагического синдрома, выраженной анемии, также высочайшего риска развития осложнений заразного нрава является основанием для внедрения выжидательной стратегии в отношении пациента. В этой ситуации показано только динамическое наблюдение за лабораторными аспектами гемо - и миелопоэза.
Применение терапевтических методик для корректировки миелодиспластического синдрома оправдано только в случае выраженных клинических проявлений, также завышенного риска трансформации в лейкоз. В качестве целительных мероприятий при миелодиспластическом синдроме используются насколько ограниченные, так и хирургические методики.
Наибольшее распространение получила так именуемая сопроводительная замещающая терапия, которая предполагает внутривенное введение компонент крови в виде эритроцитарной массы либо тромбоконцентрата. Следует учесть, что длительная терапия с применением гемокомпонентов безизбежно провоцирует перенасыщение организма пациента железом, которое в завышенной концентрации оказывает токсическое воздействие на все органы и структуры, вызывая нарушение их функции. Беря во внимание данную особенность, гемотрансфузию следует соединять с применением препаратов, связывающих железо и содействующих его элиминации из организма (Десферал в дневной дозе 20 мг на 1 кг веса пациента парентерально).
Парентеральное введение эритропоэтина, тромбопоэтина и гранулоцитарного колониестимулирующего фактора употребляется в качестве дополнительной симптоматической терапии и никаким образом не оказывает влияние на длительность жизни пациента, что в данной ситуации является приоритетным показателем эффективности исцеления миелодиспластического синдрома.
Наличие у пациента рефрактерной анемии, насколько 1-го из компонент миелодиспластического синдрома является обоснованием для внедрения средств иммуносупрессивной терапии (Леналипомид в дневной дозе 25 мг).
Препаратом с доказанной эффективностью в отношении предотвращения развития лейкоза при миелодиспластическом синдроме является Азацитидин, применение которого проводится по определенной схеме. 1-ый курс терапии продолжается семь дней, в течение которых пациенту внутривенно вводят Азацитидин в дневной дозе 75 мг/м2. В течение следующих циклов терапии дневная доза для пациента рассчитывается в соотношении 100 мг/м2. Кратность курсовой терапии составляет одну неделю каждый месяц. Следует учесть, что эффект от внедрения Азацитидина может быть очень насыщенным, в связи с чем, каждому приему продукта должно предшествовать исследование клинического анализа крови. Оценку гематологических конфигураций следует проводить после введения продукта. Абсолютным противопоказанием для внедрения Азацитидина является наличие у пациента тяжеленной органической патологии печени и почек, потому что препараты этой фармакологической группы является высокогепатотоксичными. В связи с тем, что продукты метаболизма при распаде Азацитидина элиминируются при помощи выделительной функции почек, создаются условия для токсического поражения этих структур, потому применение продукта должно проводиться под динамическим контролем характеристик креатинина и мочевины в крови, насколько главных маркеров почечной дефицитности.
Несмотря на положительные результаты внедрения медикаментозной корректировки миелодиспластического синдрома, единственным патогенетически обоснованным способом исцеления, позволяющим в 95% случаев достигнуть полной ремиссии, является аллогенная трансплантация стволового гемопоэтического клеточного субстрата, но областью внедрения данной методики исцеления является категория пациентов не старше 55 лет, что ограничивает ее применение. Данные ограничения обоснованы тем, что в приклонном возрасте пациенты тяжело переносят химиотерапию, которая в неотклонимом порядке проводится в качестве подготовки пациента к трансплантации. Не считая того, следует учесть, что в 10% случаев после трансплантации может развиваться отторжение трансплантата, что является угрожающим для жизни пациента состоянием. В ближайшее время довольно удачно применяется трансплантация стволовых клеток, забранных не из костного мозга, а из циркулирующей периферической крови.
Миелодиспластический синдром прогноз
В большей степени прогноз при том либо ином виде миелодиспластического синдрома находится в зависимости от патогенетического варианта течения данной патологии, также от наличия либо отсутствия томных осложнений.
Последние исследования в гематологии были посвящены разработке критериев оценки прогноза для жизни пациентов, страдающих миелодиспластическим синдромом. В практической деятельности гематологи и трансфузиологии употребляют международную систематизацию IPSS, согласно которой выделяется три главных группы риска (низкая, промежная и высочайшая). Главными параметрами в оценке прогноза при миелодиспластическом синдроме выступает процентное содержание бластных клеток в костном мозге, профиль хромосомных аномалий, также выраженность цитопении. Более подходящее течение наблюдается у пациентов, у каких отмечается 0 баллов по систематизации IPSS. Средняя длительность жизни при высочайшем риске по данной систематизации составляет менее 6 месяцев.
Миелодиспластический синдром – какой доктор поможет? При наличии либо подозрении на развитие миелодиспластического синдрома следует немедленно обратиться за консультацией к таким докторам насколько гематолог, гемотрансфузиолог, иммунолог и онколог.
27.07.2024